Molarna masa kisika. Koja je molarnu masu kisika?
Atomi elemenata i molekula tvari posjedujuzanemariva količina mase. Za proučavanje kvantitativnih odnosa karakterističnih za kemijske reakcije, koristi se nekoliko fizičkih veličina. Jedan od njih je molarna masa koja se može izračunati za atome, ione i molekule. Jedan od najvažnijih elemenata na Zemlji je kisik, mnoge reakcije i procesi se odvijaju uz njegovo sudjelovanje. Za izračunavanje pomoću formule spojeva, reakcijske jednadžbe koriste molarnu masu kisika, koja je numerički jednaka relativnoj masi njegovog atoma ili molekule.
kisik
Opće informacije o kisiku (kemijski element):
- latinski naziv je oksigenium;
- kemijski simbol - O;
- je u gornjem dijelu 16. skupine (nekad skupine VI A) periodičnog stola;
- se nalazi u drugom razdoblju neposredno nakon dušika, prije fluorida;
- pripada obitelji kalkogena;
- broj elementa u periodičnoj tablici i naboj jezgri njegovih atoma je 8.
Kisik kao jedna od komponenti atmosfere je dugvrijeme nije moglo razlikovati u čistom obliku. Plin se zvao "životom", "eliksirom života". Čast otkrića kisika dijele među sobom znanstvenici sa svjetskim ugledom: K. Scheele, J. Priestley, A. Lavoisier. Termin "kisik" predložio je A. Lavoisier, polazeći od važne uloge tvari, njegovih atoma u formiranju oksida i kiselina.

Kako pronaći molarnu masu nekog elementa ili tvari?
Kada izvodite kemijske proračune, morate znatimasa tvari koje sudjeluju u reakcijama atoma i molekula. Ali oni su premali, što je teško koristiti jedinice poput gramova i kilograma. Pronađena je proizvodnja: predložene su druge količine za olakšavanje izračuna. Na primjer, u kemiji se rabe relativne vrijednosti atomske i molekularne mase. Relativna masa atoma (Ar) kao fizička količina uvedena je 1961. godine. Njegova je vrijednost jednaka 1/12 mase ugljikovog atoma (izotop 12C).
Za izvođenje izračuna pomoću formule i jednadžbe s korištenjem ovog i drugih vrijednosti treba imati na umu nekoliko pravila:
- Masa atoma je naznačena u periodičnom stolu pored kemijskog znaka. Molarna masa ima istu brojčanu vrijednost, ali s mjernim jedinicama g / mol.
- Masa jednog mola supstancije određena je formulom spoja, za koju je pronađen zbroj molarnih masa svih čestica u molekuli.
- Ako kemijska formula ima indeks koji pokazuje broj strukturnih jedinica, onda je potrebno pomnožiti molarnu masu ovim koeficijentom.
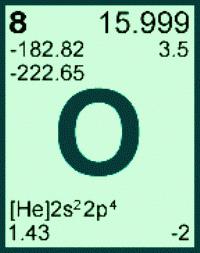
Atomska i molekularna težina kisika
Masa kisikovog atoma dobiva se sakoličinu i raspodjelu triju prirodnih izotopa: Ar (O) = 15.999 (u ae m). U izračunima ova vrijednost obično je zaobljena, ispada 16. Za svaki element, njegova atomska masa je konstantna vrijednost. Prema poznatoj masi atoma elementa s serijskim brojem 8 može se pronaći molarnu masu kisikovog elementa. M (O) = 16. Druga dimenzionirana fizička veličina, molekularna masa kisika, odnosi se na jednostavnu supstancu. Izračunajte masu molekule kisika množenjem mase atoma pomoću stehiometrijskog koeficijenta u formuli: G. (O2) = Ar (0) . 2 = 16 . 2 = 32. U praksi nema potrebe saznati što je molarna masa kisika, jer je njegova vrijednost numerički jednaka masi molekule tvari, ali s jedinicom mjerenja g / mol. Za određeni spoj njegova molekularna težina je konstanta, koja se široko koristi za izračunavanje količine i mase tvari.

Količina tvari
U kemiji, za praktičnost izračuna, jedanod najvažnijih fizičkih veličina - količina materije. Ne odnosi se na masu već na broj strukturnih jedinica. Jedinica mjerenja količine tvari u međunarodnom sustavu (SI) je 1 mol. Znajući da 1 mol sadrži čestice koje sadrže 12 g ugljičnog izotopa 12C, moguće je izračunati broj atoma, molekula, iona,elektrona sadržanih u uzorku bilo koje tvari. Još jedna konstanta vrijednost imenovana je po velikom talijanskom znanstveniku Avogadro (označenom s NAh.), To harakterizuetchislo strukturne čestice da soderzhitveshhestvo, ako je 1 mol.Numerička vrijednost je Avogadrov broj je 6,02 . 1023 1/Žarko ovaj broj atoma (molekule, iona) obladaetmoljarnoj.Oznaka fizičke količina je m, mjerna jedinica je 1 g/mol, formula za izračun je m = m/n (m = masa (g), n je množina tvari (mol)).
Što je Molarna masa kisika
U praksi, u netneobhodimosti koristiti formule m = m/n za izračunavanje molne mase kisika.Pri rješavanju zadataka često želite utvrditi što je težinu ili broj tvari.U prvom slučaju ispolzujutdlja izračuna formule m = n . M, drugi je n = m/M. brojčanu vrijednost molarne mase elementa je jednakamase atoma, a tvar je molekula, na primjer, masa 16 g1 mol elementa kisika metara (oko2) je Molarna masa molekule kisika, koji je jednak 32 g/mol.

Molarna masa kisika jednak
Ekvivalent za nazyvajutvelichinu jednaka masi 1 mol atoma bilo koji element odnovalentnogo.Općenito možete odrediti ekvivalent mase, dijeljenjem moljarnuju masa atoma kemijski element u svojim Valence, formulu za određenu vezu.U većini svojih spojeva kisika kao kemijski element halkogen, dvuhvalenten. Molarna masa kisika možese naći u tablici periodnog zaobljeni vrijednost je 16.Jednaka 2 puta manje težine-8. U kemiji, zakon ekvivalenti, koja navodi da tvari unesitereakcijom između količine njihovih ekvivalenata. prilikom obavljanja izračuna možete koristiti moljarnuju puno kisika ekvivalent za određivanje mase ekvivalentan tvari za koje nije poznato.

Kisik je jedan od najvažnijih elemenata u Zemljinoj kori, računovodstvo za 46,6% mase.Jednostavna veza s istim nazivom je drugi najčešći u Zemljinu atmosferu.Sadržaj molekule kisika u zraku – 20.947% po volumenu.Uz sudjelovanje atoma i molekula tvari elementa protekajutmnogie reakcije i procesa u tehnologiji, industriji, animirati i neživ prirode.To je važno uzeti u obzir kvantitativne odnose u tim procesima, što olakšavakorištenje fizičkih veličina, uključujući molne mase kisika.
</ p>

