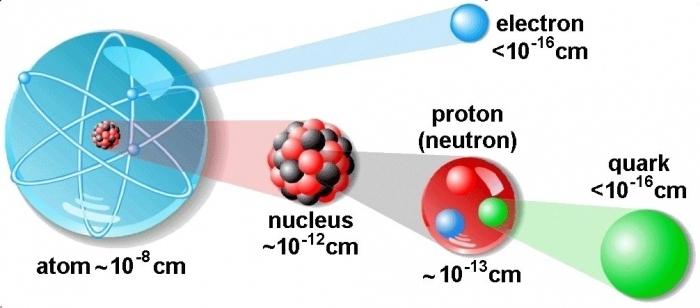
Vodikov atom je najjednostavniji element
Vodik je kemijski element, najjednostavnijiu svojoj strukturi i najčešće u prirodi. Prema nekim znanstvenim podacima ovaj element čini više od devedeset posto svih atoma. Najvažniji spoj u kojem je vodik prisutan je voda. Njegova kemijska formula je napisana na sljedeći način: H2O. Vodikov atom se sastoji od jednog protona koji predstavlja jezgru i jednog elektrona. To je jedini element koji je gorivi plin.
Kako je atom vodika smješten u periodičnom stolu?
Ovaj se element nalazi na vrhu prve skupine. To je učinjeno zbog toga što vodikov atom, izgubivši svoj elektron, tvori pozitivan ion s jednim punjenjem. Međutim, pod određenim uvjetima, vodik može dobiti metalna svojstva. U normalnim uvjetima, ona pokazuje samo svojstva karakteristična za nonmetale. Vodik ima značajne razlike od ostalih elemenata koji pripadaju prvoj skupini.
Kako dobiti vodik u laboratoriju?
Vodik se može dobiti djelovanjem(vodena otopina klorovodične kiseline) = ZnCl2 (vodena otopina cinkovog oksida) + H2 (plin)
Proizvodnja vodika hidrolizom: 2H3O- + 2e- = H2 (plin) + 2H20 (voda).
Proizvodnja vodika moguće je djelovanjem alkala na aluminij ili cink. Ti metali mogu reagirati s vodenim otopinama kalijevog hidroksida ili kalijevog hidroksida. U ovom slučaju nastaje vodik:
Zn (cink) + 2OH- + 2H20 = (Zn (OH) 4) 2- (tetrahidroksociklični ion)) + H2 (plin)
Al (aluminij) + 2OH- + 6H20 = (Al (OH) 4) - (tetrahidroksumaluminatni ion) + H2 (plin).
Taj se kemijski element također može dobiti hidrolizom vodenih otopina: CaH2 (kalcijev hidrid) + 2H20 (voda) = Ca (OH) 2 (kalcijev hidroksid) + 2H2 (vodik).
Izotopi vodika
Postoje tri izotopna oblika ove kemikalijeelement: protium, deuterij i tritium. Istodobno, prirodni vodik sadrži oko 99% protioma, ostatak je deuterij. Treći izotop je radioaktivni, nestabilni izotop. Iz tog razloga, ona se nalazi u prirodi samo u obliku tragova. Tritium emitira radioaktivne čestice, a poluživot je 12,3 godine.
Izotopni oblici vodika su praktičkiiste kemijske osobine, ali se značajno razlikuju u fizičkim svojstvima. Za svaki spoj vodika postoji analog deuterija. Najvažniji od njih je deuterijev oksid (ili teška voda). Ova tvar se koristi u nuklearnim reaktorima. Dobiva se elektrolizom vode.
Kemijska svojstva vodika
Kemijski element koji se razmatra može obnoviti nemetale iz skupine 4-7, okside i organske nezasićene spojeve, oksidirati metale, što rezultira stvaranjem hidrida.
Vodikov spojevi
To su ionski, složeni i kovalentni hidridi, kao i hidridi kao što su interkalirajući spojevi.
Proizvodnja vodika
- Bohrin proces;
- iz prirodnog plina ili benzina (nafta);
- krekiranjem i reformiranjem ugljikovodika;
- pomoću elektrolize slane otopine (tj. vodene otopine natrij klorida).
Vodikov atom u kvantnoj mehanici
Vodikov atom je važan u kvantumehanika, budući da mu je problem s dva tijela ima analitičku približnu ili točnu vrijednost. Ove otopine mogu se koristiti za različite izotope vodika, ali s odgovarajućom korekcijom. Vodikov atom u kvantnoj mehanici opisan je djelovanjem valne dvostruke čestice. Također se smatra kao ne-sudjelujući elektron u elektrostatskom polju atomske teške jezgre.
Bohrov atom vodika
Godine 1913. Bohr Nils predložio je svoj model atomavodik. Ima mnogo pojednostavljenja i pretpostavki. Unatoč činjenici da model nije bio posve korektan, Bohr je zaključio spektar zračenja i dobio točne vrijednosti energetske razine atoma.
</ p>