Razgovarajmo o tome kako odrediti vrstu hibridizacije
Razgovarajmo o tome kako odrediti vrstu hibridizacije, a također uzeti u obzir geometrijsku strukturu molekule.
Povijest izgleda
Početkom dvadesetog stoljeća, L. Pauling je predložio teoriju geometrije molekula s kovalentnom vezom. Kao osnova za formiranje komunikacije, preklapaju se elektronički oblaci. Metoda se nazvala valencijskim vezama. Kako odrediti vrstu hibridizacije atoma u spojevima? Autor teorije predložio je da se uzme u obzir miješanje hibridnih orbita.
definicija
Da bismo razumjeli kako odrediti vrstu hibridizacije u spojevima, razmotrimo što to značenje znači.

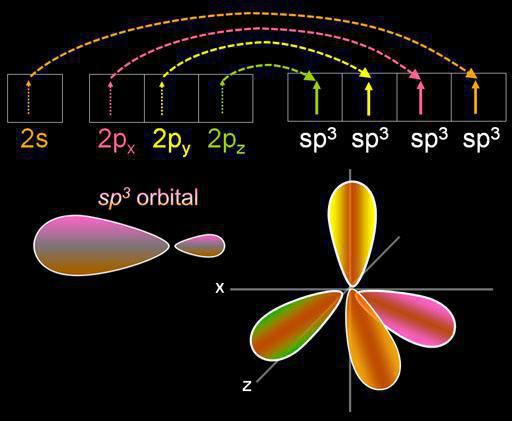
Hibridizacija je miješanjeelektronski orbitalni. Taj proces prati raspodjela energije u njima, promjena u njihovom obliku. Ovisno o tome koliko se s- i P-orbita miješaju, tip hibridizacije može biti različit. U organskim spojevima, ugljikov atom može postojati u stanju sp, sp2, sp3. Postoje složenije forme u kojima, osim sp, sudjeluju d-orbitali.
Pravila za otkrivanje anorganskih tvari u molekulama
Odredite mogućnost hibridizacije za spojeves kovalentnom kemijskom vezom, s tipom ABn. A je osnovni atom, B je ligand, a n je broj od dva ili više. U takvoj situaciji, samo valencijske orbite glavnog atoma pridružit će se hibridizaciji.
Metode određivanja
Razgovarajmo detaljnije o tome kako odrediti vrstuhibridizacija. U kemijskom smislu taj pojam podrazumijeva promjenu energije i oblika orbita. Sličan je proces uočen u onim slučajevima u kojima se elektroni koriste za formiranje veze, koji pripadaju različitim vrstama.

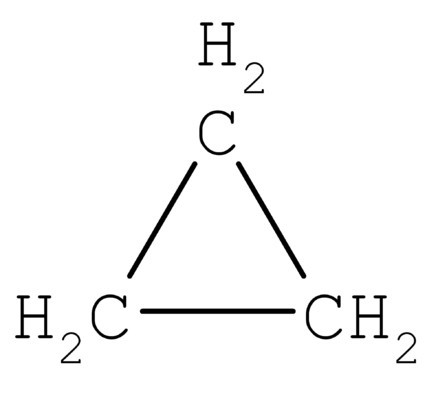
Da biste razumjeli kako odrediti vrstu hibridizacije,razmislite o molekuli metana. Ta tvar je prvi predstavnik homologne serije zasićenih (ograničavajućih) ugljikovodika. U prostoru CH4 molekula je tetraedar. Jedan atom ugljika tvori veze s vodikom, sličnim energijom i dužinom. Kako bi se stvorili takvi hibridni oblaci, koriste se tri p-i jedan es-elektron.
Četiri oblaka su pomiješani, a četiri suidentične (hibridne) vrste, koje imaju oblik nepravilnog broja - osam. Ova vrsta hibridizacije naziva se sp3. Svi ugljikovodici, koji sadrže samo jednostavne (pojedinačne) veze, karakteriziraju ovaj tip hibridizacije ugljikovog atoma. Valentinski kut iznosi 109 stupnjeva 28 minuta.
Nastavimo razgovor o tome kako utvrditi vrstuhibridizacija. Primjeri nezasićenih ugljikovodika serije etilena daju ideju sp2-hibridizacije. Na primjer, u etilenskoj molekuli od četiri valentna elektrona u formiranju kemijske veze, koriste se samo tri. Preostali ne-hibridni p-elektron ide do formiranja dvostruke veze.
Acetilen je najjednostavniji predstavnikklase CnH2n-2. Značajka ove klase ugljikovodika je prisutnost trostruke veze. Od četiri valentna elektrona ugljikovog atoma, samo njih dvije mijenjaju oblik i energiju, postaju hibridni. Dva preostala elektrona sudjeluju u formiranju dviju dvostrukih veza, određujući nezasićenu prirodu ove klase organskih spojeva.
zaključak
S obzirom na pitanje kovalentnostikemijske veze za organske i anorganske tvari, uzimaju u obzir hibridizaciju atomskih orbitala. Ovo usklađuje njihovu energiju i oblik. Elektron smješten blizu jezgre vezanog atoma karakterizira skup orbita koji imaju isti kvantni broj. Informacije o vrsti hibridizacije omogućuju procjenu kemijskih svojstava tvari.
</ p>